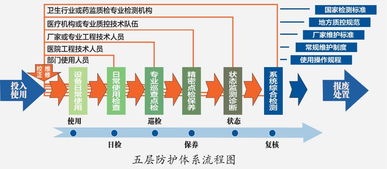
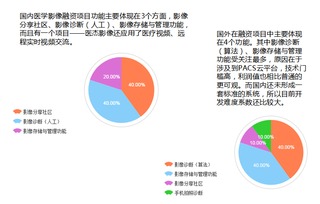
医疗器械指导原则汇总

一、医疗器械分类与标签

1. 医疗器械分类标准
医疗器械按照风险程度分为三类:第一类、第二类和第三类。其中,第一类医疗器械风险程度低,实行常规管理;第二类医疗器械风险程度较高,需要加强监管;第三类医疗器械风险程度高,需要严格监管。

2. 标签和说明书要求
医疗器械的标签和说明书必须清晰、准确、完整地描述产品的名称、型号、规格、性能指标、使用方法、注意事项等。同时,标签和说明书还必须符合国家相关法规和标准的要求。
二、医疗器械注册与备案

1. 注册程序及要求
医疗器械注册需要按照国家相关法规和标准的要求进行。注册申请人需要提交相关申请资料,包括产品技术文档、产品注册申请表等。注册过程中需要对产品进行技术审评和行政审批。注册成功后,申请人可以获得医疗器械注册证书。
2. 备案程序及要求
对于第二类和第三类医疗器械,需要进行备案。备案需要提交相关申请资料,包括产品技术文档、产品备案申请表等。备案过程中需要对产品进行技术审评和行政审批。备案成功后,申请人可以获得医疗器械备案凭证。
三、医疗器械生产与经营

1. 生产许可与备案
医疗器械生产需要取得相应的生产许可或备案。生产许可需要按照国家相关法规和标准的要求进行申请和审批。生产备案需要提交相关申请资料,包括产品技术文档、生产备案申请表等。生产许可或备案有效期满前需要提前申请延续或重新申请。
2. 经营许可与备案
医疗器械经营需要取得相应的经营许可或备案。经营许可需要按照国家相关法规和标准的要求进行申请和审批。经营备案需要提交相关申请资料,包括产品技术文档、经营备案申请表等。经营许可或备案有效期满前需要提前申请延续或重新申请。
四、医疗器械不良事件监测与报告

1. 不良事件监测要求
医疗器械生产企业、经营企业和使用单位应当建立医疗器械不良事件监测制度,对所生产的医疗器械或者经营的医疗器械以及使用中的医疗器械的不良事件进行监测。发现不良事件应当及时报告,并按照国家有关规定处理。
2. 不良事件报告程序
医疗器械生产企业、经营企业和使用单位应当按照国家有关规定向所在地食品药品监督管理部门报告所发现的医疗器械不良事件。报告应当包括不良事件的发生情况、产品相关信息、调查情况、处理情况等内容。同时,还应当配合相关部门进行调查和处理工作。
五、医疗器械召回管理

1. 召回级别与流程
医疗器械召回分为三级:一级召回为最紧急的情况,必须立即停止使用并召回相关产品;二级召回为需要尽快采取措施的严重不良事件;三级召回为一般不良事件,但也需要采取措施进行控制。召回流程包括制定召回计划、通知相关方、实施召回、记录和处理等步骤。
2. 召回后处理要求
对于已经召回的医疗器械,需要进行相应的处理工作。包括对召回产品进行封存和处理,对相关方进行通知和解释工作,对召回效果进行评估和报告等。同时,还应当配合相关部门进行调查和处理工作。
六、医疗器械临床试验管理

1. 试验方案设计与实施
医疗器械临床试验必须按照国家相关法规和标准的要求进行设计和实施。试验方案应当明确试验目的、方法、样本量、观察指标等内容,并经过伦理委员会审查批准后方可实施。试验过程中应当严格遵守试验方案和伦理规范,确保受试者的权益和安全。
2. 试验数据管理与分析
医疗器械临床试验数据是评价产品安全性和有效性的重要依据。因此,必须对试验数据进行严格的管理和分析工作。包括数据的收集、整理、存储和分析等工作。同时,还应当配合相关部门进行调查和处理工作。